FMR1
FMR1 (gen mentalne retardacije fragilnog X 1) je ljudski gen[5] koji kodira protein zvani protein mentalne retardacije fragilnog X ili FMRP.[6] Ovaj protein, koji se najčešće nalazi u mozgu, neophodan je za normalni kognitivni razvoj i reproduktivnu funkciju žena. Mutacije ovog gena mogu izazvati sindrom fragilnog X, intelektualnu invalidnost, prerano otkazivanje jajnika, autizam, Parkisonovu bolest, kašnjenja u razvoju i druge kognitivnne nedostatke.[7] Premutacija FMR1 vezana je sa spektrom kliničkih fenotpova koji pogađaju više od dva miliona ljudi.[8]
Funkcija
urediPlastičnost sinapsi
urediFMRP ima raznolik niz funkcija u različitim područjima neurona; međutim ove funkcije nisu u potpunosti okarakterizirane. Predloženo je da FMRP ima ulogu u nukleocitoplazmatskoj translaciji iRNK, lokalizaciji dendritske iRNL i sintezu peroteina u sinapsama.[9] Studije sindoma fragilnog X značajno su pomogle u razumijevanju funkcionalnosti FMRP-a pomoću uočenih efekata gubitka FMRP-a na neurone. Mišji model mentalne retardacije zbog fragilnog X implicirao je dokazao uključenost FMRP-a u plastičnost sinapse..[10] Sinapsna plastičnost zahtijeva proizvodnju novih proteina, kao odgovor na aktivaciju sinapsnih receptora. Pretpostavlja se da proizvodnja proteina kao odgovor na stimulaciju omogućava trajne fizičke promjene i promijenjene sinapsne veze povezane s procesima učenja i pamćenja.
U plasičnosti sinapsi ovisnoj o FMRP važnu ulogu imao je metabotropni glutamatni receptor 1. grupe signalizacije (mGluR). Post-sinapsna mGluR stimulacija rezultira pojačanom regulacijom sinteze proteina kroz sistem drugog glasnika.[11] O ulozi mGluR-a u plastičnosti sinapsi dodatno svjedoči promatranje izduženja dendritske bodlje nakon stimulacije.[12] Nadalje, aktivacija mGluR rezultira sintezom FMRP blizu sinapsi. Proizvedeni FMRP povezuje se sa poliribosomskim kompleksima, nakon stimulacije mGluR-om, eksprimirajući uključivanje proteina mentalne retardacije fragilnog X u procesu translacije. Ovo dalje podržava ulogu FMRP-a u sintezi proteina i rastu sinapsnih veza.[13] Gubitak FMRP-a rezultira abnormalnim fenotipom dendrita. Konkretno, delecija gena FMR1 u uzorku miševa rezultirala je povećanjem broja sinapsnik kićmi.[14]
Uloga u translaciji
urediPredloženi mehanizam efekta FMRP-a na plastičnost sinapsi je kroz njegovu ulogu negativnog regulatora translacije. FMRP je protein koji veže RNK i povezuje se sa poliribosomima.[13][15] > Sposobnosti FMRP-a da vežu za RNK zavise od njegovih KH domena i RGG polja. KH domen je konzervirani motiv, koji karakterizira mnoge RNA-vezujuće proteine. Mutageneza ovog domena rezultirala je poremećenim vezivanjem FMRP-a za RNK.[16]
Pokazano je da FMRP inhibira translajiju iRNK. Mutacija FMRP proteina rezultirala je nemogućnošću suzbijanja translacije za razliku od divljeg tipa, koji je to mogao učiniti.[17] Kao što je prethodno pomenuto, stimulacija mGluR povezana je s povećanim nivoom FMRP proteina. Pored toga, stimulacija mGluR rezultira povećanim nivoom FMRP ciljanih iRNK. Studija je pokazala da su bazni nivoi proteina kodirani ovim ciljnim iRNK značajno povišeni i nepravilno regulirani kod miševa s nedostatkom FMRP-a .[18]
Represija pri translaciji FMRP djeluje tako što inhibira pokretanje translacije. FMRP izravno veže CYFIP1, što zauzvrat veže faktor inicijacije prevođenja eIF4E. Kompleks FMRP-CYFIP1 sprečava inicijaciju ovisnu o eIF4E, djelujući tako na represiju translacije.[19] Kada se primijeni na uočeni fenotip kod sindroma fragilnog X, višak nivoa proteina i smanjenje translaciijke kontrole mogu se objasniti gubitkom represije translacije FMRP-om kod sinroma fragilnog X.[19][20] FMRP deluje na kontrolu translacije velike grupe ciljnih iRNK; međutim opseg translacijske kontrole FMRP-a je nepoznat. Pokazalo se da protein potiskuje prevođenje ciljanih iRNK u sinapsama, uključujući one koji kodiraju citoskeletne proteine Arc / Arg3.1 i MAP1B, te CaM kinazu II.[21] Pored toga, FMRP veže PSD-95 i GluR1/2 iRNK. Važno je da ove FMRP-vezujuće iRNK imaju značajnu ulogu u plastičnosti neurona.
Pokazalo se da je translacijska kontrola FMRP regulirana mGluR-signalizacijom. Stimulacija mGluR može rezultirati transportom iRNK kompleksa u sinapse za lokalnu sintezu proteina. Pritom se FMRP granule lokaliziraju sa MAP1B iRNK i rRNK u dendritima, što sugerira da će ovaj kompleks u cjelini možda trebati transportirati u dendrite za lokalnu sintezu proteina. Pored toga, utvrđeno je da su za mGluR-zavisnu translokaciju FMRP-a u dendrite neophodne i mikrotubule
FMRP može imati dodatnu ulogu u lokalnoj sintezi proteina, pomažući u povezivanju tereta iRNK i mikrotubula.[22] Dakle, FMRP je u stanju da reguliše efikasnost transporta, kao i potiskivanje prevođenja tokom transporta. Konačno, FMRP sinteza, ubikvitinacija i proteoliza brzo se javljaju kao odgovor na mGluR signalizaciju, što sugerira izuzetno dinamičnu ulogu translacijskog regulatora.
Ekspresija gena
urediGen FMR1 nalazi se na X hromosomu i sadrži ponavljajući CGG trinukleotid. Kod većine ljudi, segment CGG se ponovi približno 5-44 puta. Veći broj ponavljajućih segmenta CGG povezan je sa oštećenom kognitivnom i reproduktivnom funkcijom. Ako osoba ima 45-54 ponavljanja, to se smatra "sivom zonom" ili graničnim rizikom, 55-200 ponavljanja naziva se predmutacijom, a više od 200 ponavljanja – punom mutacijom gena FMR1, prema Američkom koledžu za medicinsku genetiku i genomiku.[23] Prva kompletna sekvence ponavljajućeg širenja DNK kod nekoga sa potpunom mutacijom dobijena je 2012., pomoću SMART sekvenciranja.[24] Ovo je primjer poremećaja ponavljanja trinukleotida. Ekspanzija trinukleotidnog ponavljanja vjerovatno je posljedica proklizavanja niti tokom popravki ili replikacije DNK.[25]
FMR1 je protein koji veže hromatin i funkcionira u odgovoru na oštećenje DNK.[26][27] FMR1 zauzima mjesta na mejotskm hromosomu i regulira dinamiku mehanizama odgovora na oštećenje DNK tokom sperspermatogeneze.
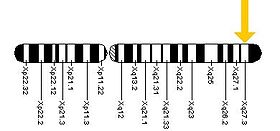
Gen FMR1 nalazi se na dugom (q) kraku X hromosoma, na položaju 27.3, od baznog para 146,699.054 do para 146,738.156
Vezane promjene
urediSindrom fragilnog X
urediGotovo svi slučajevi sindroma fragilnog X-a su uzrokovani ekspanzijom CGG trinukleotidnog ponavljanja u genu FMR1. U tim slučajevima, CGG se abnormalno ponavlja od 200 do više od 1.000 puta. Kao rezultat, ovaj dio gena FMR1 je metiliran, što utišava gen (isključen je i ne stvara nikakve proteine). Bez odgovarajućeg FMR1, mogu se razviti teške smetnje u učenju ili intelektualne smetnje, zajedno sa fizičkim abnormalnostima.
Manje od 1% svih slučajeva sindroma fragilnog X uzrokuju mutacije koji deletiraju dio ili cijeli gen FMR1 ili mijenjaju bazni par, što dovodi do promjene jedne od mutiranih aminokiselina u genu (tačkasta mutacija). Ove mutacije remete trodimenzijski oblik FMRP-a ili sprečavaju sintezu proteina, što dovodi do znakova i simptomansindroma fragilnog X .
Sekvenca CGG u genu FMR1 koja se ponavlja između 55 i 200 puta opisana je kao predmutacija. Iako je većina osoba s premutacijom intelektualno normalna, neke od njih imaju blage verzije fizičkih karakteristika koje se vide kod sindroma krhkog X (poput istaknutih ušiju), a mogu imati i mentalnih problema, poput anksioznosti ili depresije.
Sindrom X-vezane tremor / sindrom ataksije
urediPremutacije su povezane sa povećanim rizikom od sidroma X-fragilno vezanog tremora ataksije (FXTAS). FXTAS karakteriziraju ataksija (gubitak koordinacije), tremor, gubitak pamćenja, gubitak osjećaja u donjim ekstremitetima (periferna neuropatija) i mentalne i promjene ponašanja. Poremećaj se obično razvija kasno u životu.
Prerano starenje jajnika
urediGen FMR1 ima vrlo važnu ulogu u funkciji jajnika, neovisno o kognitivnim/nervnim efektima. Manja proširenja ponavljanja CGG koja ne uzrokuju sindrom fragilnog X povezani su s povećanim rizikom za prerano starenje jajnika, koji se naziva i okultnom primarnom insuficijencijom jajnika, stanjem u kojem žene prerano iscrpljuju funkciju jajnika.[28][29][30]
Sindrom policistnih jajnika
urediUtvrđeno je da je vrlo specifičan pod-genotip FMR1 povezan sa sindromom višecistnih jajnika (PCOS). Ekspresija gena, koja se naziva heterozigotno-normalna/niska, može prouzrokovati prekomjernu aktivnost folikula nalik PCOS-u i hiperaktivnu funkciju jajnika mlađih žena.
Interakcije
urediPokazano je da FMR1 ima interakcije sa:
Reference
uredi- ^ a b c GRCh38: Ensembl release 89: ENSG00000102081 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000000838 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Verkerk AJ, Pieretti M, Sutcliffe JS, Fu YH, Kuhl DP, Pizzuti A, Reiner O, Richards S, Victoria MF, Zhang FP (maj 1991). "Identification of a gene (FMR-1) containing a CGG repeat coincident with a breakpoint cluster region exhibiting length variation in fragile X syndrome". Cell. 65 (5): 905–14. doi:10.1016/0092-8674(91)90397-H. PMID 1710175.
- ^ Verheij C, Bakker CE, de Graaff E, Keulemans J, Willemsen R, Verkerk AJ, Galjaard H, Reuser AJ, Hoogeveen AT, Oostra BA (juni 1993). "Characterization and localization of the FMR-1 gene product associated with fragile X syndrome". Nature. 363 (6431): 722–4. doi:10.1038/363722a0. hdl:1765/56659. PMID 8515814.
- ^ "Fragile X Mental Retardation" The Human Gene Compendium
- ^ Milà M, Rodriguez-Revenga L, Matilla-Dueñas A (oktobar 2016). "FMR1 Premutation: Basic Mechanisms and Clinical Involvement". Cerebellum. 15 (5): 543–5. doi:10.1007/s12311-016-0808-7. PMID 27338822.
- ^ Antar LN, Dictenberg JB, Plociniak M, Afroz R, Bassell GJ (august 2005). "Localization of FMRP-associated mRNA granules and requirement of microtubules for activity-dependent trafficking in hippocampal neurons". Genes, Brain, and Behavior. 4 (6): 350–9. doi:10.1111/j.1601-183X.2005.00128.x. PMID 16098134.
- ^ Huber KM, Gallagher SM, Warren ST, Bear MF (maj 2002). "Altered synaptic plasticity in a mouse model of fragile X mental retardation". Proceedings of the National Academy of Sciences of the United States of America. 99 (11): 7746–50. doi:10.1073/pnas.122205699. PMC 124340. PMID 12032354.
- ^ Weiler IJ, Greenough WT (august 1993). "Metabotropic glutamate receptors trigger postsynaptic protein synthesis". Proceedings of the National Academy of Sciences of the United States of America. 90 (15): 7168–71. doi:10.1073/pnas.90.15.7168. PMC 47097. PMID 8102206.
- ^ Vanderklish PW, Edelman GM (februar 2002). "Dendritic spines elongate after stimulation of group 1 metabotropic glutamate receptors in cultured hippocampal neurons". Proceedings of the National Academy of Sciences of the United States of America. 99 (3): 1639–44. doi:10.1073/pnas.032681099. PMC 122243. PMID 11818568.
- ^ a b Weiler IJ, Irwin SA, Klintsova AY, Spencer CM, Brazelton AD, Miyashiro K, Comery TA, Patel B, Eberwine J, Greenough WT (maj 1997). "Fragile X mental retardation protein is translated near synapses in response to neurotransmitter activation". Proceedings of the National Academy of Sciences of the United States of America. 94 (10): 5395–400. doi:10.1073/pnas.94.10.5395. PMC 24689. PMID 9144248.
- ^ Antar LN, Li C, Zhang H, Carroll RC, Bassell GJ (2006). "Local functions for FMRP in axon growth cone motility and activity-dependent regulation of filopodia and spine synapses". Molecular and Cellular Neurosciences. 32 (1–2): 37–48. doi:10.1016/j.mcn.2006.02.001. PMID 16631377.
- ^ Brown V, Small K, Lakkis L, Feng Y, Gunter C, Wilkinson KD, Warren ST (juni 1998). "Purified recombinant Fmrp exhibits selective RNA binding as an intrinsic property of the fragile X mental retardation protein". The Journal of Biological Chemistry. 273 (25): 15521–7. doi:10.1074/jbc.273.25.15521. PMID 9624140.
- ^ Siomi H, Choi M, Siomi MC, Nussbaum RL, Dreyfuss G (april 1994). "Essential role for KH domains in RNA binding: impaired RNA binding by a mutation in the KH domain of FMR1 that causes fragile X syndrome". Cell. 77 (1): 33–9. doi:10.1016/0092-8674(94)90232-1. PMID 8156595.
- ^ Laggerbauer B, Ostareck D, Keidel EM, Ostareck-Lederer A, Fischer U (februar 2001). "Evidence that fragile X mental retardation protein is a negative regulator of translation". Human Molecular Genetics. 10 (4): 329–38. doi:10.1093/hmg/10.4.329. PMID 11157796.
- ^ Hou L, Antion MD, Hu D, Spencer CM, Paylor R, Klann E (august 2006). "Dynamic translational and proteasomal regulation of fragile X mental retardation protein controls mGluR-dependent long-term depression". Neuron. 51 (4): 441–54. doi:10.1016/j.neuron.2006.07.005. PMID 16908410.
- ^ a b Napoli I, Mercaldo V, Boyl PP, Eleuteri B, Zalfa F, De Rubeis S, Di Marino D, Mohr E, Massimi M, Falconi M, Witke W, Costa-Mattioli M, Sonenberg N, Achsel T, Bagni C (septembar 2008). "The fragile X syndrome protein represses activity-dependent translation through CYFIP1, a new 4E-BP". Cell. 134 (6): 1042–54. doi:10.1016/j.cell.2008.07.031. PMID 18805096.
- ^ Muddashetty RS, Kelić S, Gross C, Xu M, Bassell GJ (maj 2007). "Dysregulated metabotropic glutamate receptor-dependent translation of AMPA receptor and postsynaptic density-95 mRNAs at synapses in a mouse model of fragile X syndrome". The Journal of Neuroscience. 27 (20): 5338–48. doi:10.1523/JNEUROSCI.0937-07.2007. PMC 6672337. PMID 17507556.
- ^ Zalfa F, Giorgi M, Primerano B, Moro A, Di Penta A, Reis S, Oostra B, Bagni C (februar 2003). "The fragile X syndrome protein FMRP associates with BC1 RNA and regulates the translation of specific mRNAs at synapses". Cell. 112 (3): 317–27. doi:10.1016/S0092-8674(03)00079-5. PMID 12581522.
- ^ Estes PS, O'Shea M, Clasen S, Zarnescu DC (oktobar 2008). "Fragile X protein controls the efficacy of mRNA transport in Drosophila neurons". Molecular and Cellular Neurosciences. 39 (2): 170–9. doi:10.1016/j.mcn.2008.06.012. PMID 18655836.
- ^ "Technical Standards and Guidelines for Fragile X". American College of Medical Genetics. 2. 10. 2000. Arhivirano s originala, 17. 6. 2018. Pristupljeno 29. 3. 2013.
- ^ Loomis EW, Eid JS, Peluso P, Yin J, Hickey L, Rank D, McCalmon S, Hagerman RJ, Tassone F, Hagerman PJ (januar 2013). "Sequencing the unsequenceable: expanded CGG-repeat alleles of the fragile X gene". Genome Research. 23 (1): 121–8. doi:10.1101/gr.141705.112. PMC 3530672. PMID 23064752.
- ^ Usdin K, House NC, Freudenreich CH (2015). "Repeat instability during DNA repair: Insights from model systems". Crit. Rev. Biochem. Mol. Biol. 50 (2): 142–67. doi:10.3109/10409238.2014.999192. PMC 4454471. PMID 25608779.
- ^ Alpatov R, Lesch BJ, Nakamoto-Kinoshita M, Blanco A, Chen S, Stützer A, Armache KJ, Simon MD, Xu C, Ali M, Murn J, Prisic S, Kutateladze TG, Vakoc CR, Min J, Kingston RE, Fischle W, Warren ST, Page DC, Shi Y (maj 2014). "A chromatin-dependent role of the fragile X mental retardation protein FMRP in the DNA damage response". Cell. 157 (4): 869–81. doi:10.1016/j.cell.2014.03.040. PMC 4038154. PMID 24813610.
- ^ Dockendorff TC, Labrador M (maj 2018). "The Fragile X Protein and Genome Function". Mol. Neurobiol. 56 (1): 711–721. doi:10.1007/s12035-018-1122-9. PMID 29796988.
- ^ Gleicher N, Barad DH (august 2010). "The FMR1 gene as regulator of ovarian recruitment and ovarian reserve". Obstetrical & Gynecological Survey. 65 (8): 523–30. doi:10.1097/OGX.0b013e3181f8bdda. PMID 20955631.
- ^ Chatterjee S, Maitra A, Kadam S, Patel Z, Gokral J, Meherji P (august 2009). "CGG repeat sizing in the FMR1 gene in Indian women with premature ovarian failure". Reproductive Biomedicine Online. 19 (2): 281–6. doi:10.1016/s1472-6483(10)60086-7. PMID 19712568.
- ^ Streuli I, Fraisse T, Ibecheole V, Moix I, Morris MA, de Ziegler D (august 2009). "Intermediate and premutation FMR1 alleles in women with occult primary ovarian insufficiency". Fertility and Sterility. 92 (2): 464–70. doi:10.1016/j.fertnstert.2008.07.007. PMID 18973899.
- ^ a b Schenck A, Bardoni B, Moro A, Bagni C, Mandel JL (juli 2001). "A highly conserved protein family interacting with the fragile X mental retardation protein (FMRP) and displaying selective interactions with FMRP-related proteins FXR1P and FXR2P". Proceedings of the National Academy of Sciences of the United States of America. 98 (15): 8844–9. doi:10.1073/pnas.151231598. PMC 37523. PMID 11438699.
- ^ a b c Bardoni B, Castets M, Huot ME, Schenck A, Adinolfi S, Corbin F, Pastore A, Khandjian EW, Mandel JL (juli 2003). "82-FIP, a novel FMRP (fragile X mental retardation protein) interacting protein, shows a cell cycle-dependent intracellular localization". Human Molecular Genetics. 12 (14): 1689–98. doi:10.1093/hmg/ddg181. PMID 12837692.
- ^ a b Siomi MC, Zhang Y, Siomi H, Dreyfuss G (juli 1996). "Specific sequences in the fragile X syndrome protein FMR1 and the FXR proteins mediate their binding to 60S ribosomal subunits and the interactions among them". Molecular and Cellular Biology. 16 (7): 3825–32. doi:10.1128/mcb.16.7.3825. PMC 231379. PMID 8668200.
- ^ a b Zhang Y, O'Connor JP, Siomi MC, Srinivasan S, Dutra A, Nussbaum RL, Dreyfuss G (novembar 1995). "The fragile X mental retardation syndrome protein interacts with novel homologs FXR1 and FXR2". The EMBO Journal. 14 (21): 5358–66. doi:10.1002/j.1460-2075.1995.tb00220.x. PMC 394645. PMID 7489725.
- ^ Ceman S, Brown V, Warren ST (decembar 1999). "Isolation of an FMRP-associated messenger ribonucleoprotein particle and identification of nucleolin and the fragile X-related proteins as components of the complex". Molecular and Cellular Biology. 19 (12): 7925–32. doi:10.1128/mcb.19.12.7925. PMC 84877. PMID 10567518.
- ^ Bardoni B, Schenck A, Mandel JL (decembar 1999). "A novel RNA-binding nuclear protein that interacts with the fragile X mental retardation (FMR1) protein". Human Molecular Genetics. 8 (13): 2557–66. doi:10.1093/hmg/8.13.2557. PMID 10556305.
Dopunska literatura
uredi- Bassell GJ, Warren ST (oktobar 2008). "Fragile X syndrome: loss of local mRNA regulation alters synaptic development and function". Neuron. 60 (2): 201–14. doi:10.1016/j.neuron.2008.10.004. PMC 3691995. PMID 18957214.
- Hagerman PJ, Hagerman RJ (maj 2004). "The fragile-X premutation: a maturing perspective". American Journal of Human Genetics. 74 (5): 805–16. doi:10.1086/386296. PMC 1181976. PMID 15052536.
- Hagerman RJ, Leavitt BR, Farzin F, Jacquemont S, Greco CM, Brunberg JA, Tassone F, Hessl D, Harris SW, Zhang L, Jardini T, Gane LW, Ferranti J, Ruiz L, Leehey MA, Grigsby J, Hagerman PJ (maj 2004). "Fragile-X-associated tremor/ataxia syndrome (FXTAS) in females with the FMR1 premutation". American Journal of Human Genetics. 74 (5): 1051–6. doi:10.1086/420700. PMC 1181968. PMID 15065016.
- Jacquemont S, Hagerman RJ, Leehey MA, Hall DA, Levine RA, Brunberg JA, Zhang L, Jardini T, Gane LW, Harris SW, Herman K, Grigsby J, Greco CM, Berry-Kravis E, Tassone F, Hagerman PJ (januar 2004). "Penetrance of the fragile X-associated tremor/ataxia syndrome in a premutation carrier population". JAMA. 291 (4): 460–9. doi:10.1001/jama.291.4.460. PMID 14747503.
- Jin P, Alisch RS, Warren ST (novembar 2004). "RNA and microRNAs in fragile X mental retardation". Nature Cell Biology. 6 (11): 1048–53. doi:10.1038/ncb1104-1048. PMID 15516998.
- Jin P, Warren ST (mart 2003). "New insights into fragile X syndrome: from molecules to neurobehaviors". Trends in Biochemical Sciences. 28 (3): 152–8. CiteSeerX 10.1.1.532.4162. doi:10.1016/S0968-0004(03)00033-1. PMID 12633995.
- O'Donnell WT, Warren ST (2002). "A decade of molecular studies of fragile X syndrome". Annual Review of Neuroscience. 25: 315–38. doi:10.1146/annurev.neuro.25.112701.142909. PMID 12052912.
- Oostra BA, Chiurazzi P (decembar 2001). "The fragile X gene and its function". Clinical Genetics. 60 (6): 399–408. doi:10.1034/j.1399-0004.2001.600601.x. PMID 11846731.
- Oostra BA, Willemsen R (oktobar 2003). "A fragile balance: FMR1 expression levels". Human Molecular Genetics. 12 Spec No 2 (90002): R249–57. doi:10.1093/hmg/ddg298. PMID 12952862.
- Nicola NA, Metcalf D (oktobar 1991). "Subunit promiscuity among hemopoietic growth factor receptors". Cell. 67 (1): 1–4. doi:10.1016/0092-8674(91)90564-F. PMID 1913811.
- Sielska D, Milewski M, Bal J (2003). "[Molecular pathogenesis of fragile X syndrome]". Medycyna Wieku Rozwojowego. 6 (4): 295–308. PMID 12810982.
- Bagni C, Greenough WT (maj 2005). "From mRNP trafficking to spine dysmorphogenesis: the roots of fragile X syndrome". Nature Reviews. Neuroscience. 6 (5): 376–87. doi:10.1038/nrn1667. PMID 15861180. Arhivirano s originala, 28. 3. 2021. Pristupljeno 27. 3. 2021.
- Huber KM (april 2006). "The fragile X-cerebellum connection". Trends in Neurosciences. 29 (4): 183–5. doi:10.1016/j.tins.2006.02.001. PMID 16500716.
- Loesch DZ, Bui QM, Dissanayake C, Clifford S, Gould E, Bulhak-Paterson D, Tassone F, Taylor AK, Hessl D, Hagerman R, Huggins RM (2007). "Molecular and cognitive predictors of the continuum of autistic behaviours in fragile X". Neuroscience and Biobehavioral Reviews. 31 (3): 315–26. doi:10.1016/j.neubiorev.2006.09.007. PMC 2145511. PMID 17097142.