Fosforna kiselina
Fosforna kiselina, ortofosforna kiselina ili fosfor(V)-kiselina je mineralna (neorganska) kiselina čija je hemijska formula: H3PO4. Ortofosfotna kiselina je u stvari IUPAC ime ovog spoja. Prefiks orto- se upotrebljava zbog razlikovanja od ostalih srodnih kiselina na bazi fosfora, zvanih polifosforne kiseline. Ortofosforna kiselina je netoksična, a kada je čista, na sobnoj temperaturi i pritisku je čvrsta tvar. Konjugatna baza fosforne kiseline je dihidrogen-fosfatni ion, H2PO−
4, koji se obrće u konjugiranu bazu fosfata, PO3−
4. Fosfati su hranljivi za sve oblike života.
Pored toga što je hemijski reagens, fosforna kiselina ima široku upotrebu u: inhibiciji hrđe, dodacima hrani, zaštiti stomatoloških i ortopedskih i industrijakih pomagala, elektrolita, protočnosti, raspršivanju agenasa, sirovinama za đubrivo i dijelovima kućnih proizvoda za čišćenje. Fosforne kiseline i fosfati su također važni u biologiji.
Najčešći izvor fosforne kiseline je 85% vodena otopina, a takve otopine su bezbojne, bez mirisa i nestabilne. Oko 85% otopina su sirupaste tečnosti, ali i je prečišćavanja i dalje moguće. Kao jaka kiselina, fosforna kiselina je korozivna. Zbog visokog procenta fosforne kiseline u ovom reagensu, bar neke od ortofosfornih kiselina se kondenziraju u polifosforne kiseline. Radi označavanja i jednostavnosti, 85% predstavlja H3PO4, kao da je sve ortofosforna kiselina. Razblažene vodene otopine fosforne kiseline su u orto obliku.[2][3]
| Fosforna kiselina | |
|---|---|
   | |
| Općenito | |
| Hemijski spoj | Fosforna kiselina |
| Druga imena | Ortofosforna kiselina Trihidroksilfosfin-oksid IUPAC ime: Fosforna kiselina Trihidroksidooksidofosfor |
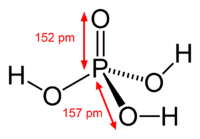
| Molekularna formula | H3PO4 |
| CAS registarski broj | 16271-20-8&rn=1 7664-38-2 16271-20-8 |
| SMILES | OP(=O)(O)O |
| InChI | 1/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
| Kratki opis | Bijela čvrsta tvar ili bezbojna viskozna tečnost (>42 °C) Topiva |
| Osobine1 | |
| Molarna masa | 98,0 g/mol |
| Agregatno stanje | tečno |
| Gustoća | 1,685 g/ml (tečnost) 1,685 g/mL (85% rastvor) 2,030 g/mL (kristal na 25 °C) |
| Tačka topljenja | 42,35 °C |
| Tačka ključanja | 158 °C |
| Pritisak pare | 0,03 mmHg (20°C) |
| Rastvorljivost | 392,2 g/100 g (−16.3 °C) 369,4 g/100 mL (0.5 °C) 446 g/100 mL (14,95 °C) Može se miješati (42,3 °C)[1] Rastvorljiva u etanolu pKa = pKa1 = 2,148 pKa2 = 7,198 pKa3 = 12,319 Viskoznost = 2,4–9,4 cP (85% aq. soln.) 147 cP (100%) |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Pregled
urediFosforna kiselina je najvažnija od mnogih fosfornih kiselina koje sadrže kisik. Njen anhidrid je kristalna supstanca sa tačkom topljenja na 42,35 °C, a koncentrirana vodena otopina, koja se obično podešava na 85%, je sirupasta tečnost. Dobija se sagorijevanjem bijelog fosfora (ili fosfornih para) i otapanjem nastalog fosfor(V)-oksida u vodi.
Drugi način je reakcija prirodnog apatita i fosforita sa sumpornom kiselinom. Vodena otopina fosforne kiseline, koja ima aktivnost na razini srednje jakih kiselina, je triprotonska kiselina, pa se od nje izvode tri niza soli: normalni fosfati (PO43-), vodik-fosfati (HPO42-) i divodik-fosfati (H2PO4-). Svi vodikovi fosfati su topivi u vodi, a oni bez vodika su topivi samo sa alkalnim metalima. Nakon zagrijavanja na temperaturama koje su više od 200 °C, ortofosforna kiselina gubitkom vode prelazi u difosfornu (pirofosfornu) kiselinu, H4P2O7, čije soli su poznate kao difosfati ili pirofosfati. Na još višim temperaturama nastaje trifosforna kiselina i naredne višeg ranga, sve do polimerne linearno lančane polifosforne kiseline. Njene soli su polifosfati – ciklične metafosforne kiseline (HPO3)n, čije soli su metafosfati.
Fosforna kiselina se najviše upotrebljava za proizvodnju svih vrsta fosfata, u tehnologiji izrade čelika, proizvodnji sredstava za zaštitu metala od hrđanja, te u farmaceutskoj industriji. Ovo je jedna od malobrojnih neškodljivih, odnosno neotrovnih kiselina, pa se upotrebljava i kao sredstvo za zakiseljivanje mnogih bezalkoholnih pića.
Reakcije
urediMolekule ortofosforne kiseline mogu se međusobno objedinjavati u različite spojeve koji se odnose na fosforne kiseline, ali na mnogo općenitiji način. Naziv fosforna kiselina se može također odnositi i na hemikalije ili reagense koji sadrže fosforne kiseline, kao što su pirofosforna ili trifosforna, ali je to obično ortofosforna kiselina.
Anhidridna fosforna kiselina je bijeli, nisko topivi čvrsti spoj, kojim se preko dehidracije dobija 85% fosforna kiselina, putem zagrijavanja u vakuumu.[4]
Ortofospforna kiselina se nakon rastvaranja u vodi ionizira i uglavnom daje H2PO4- i protone:
- H3PO4(s) + H2O(l)
H3O+(aq) + H2PO4−(aq) Ka1= 7,5×10−3
- H2PO4−(aq) + H2O(l)
H3O+(aq) + HPO42−(aq) Ka2= 6,2×10−8
- HPO42−(aq) + H2O(l)
H3O+(aq) + PO43−(aq) Ka3= 2,2×10−13
Nakon prve disocijacije, anioni H2PO4− postaju divodik-fosfatni anioni. Nakon druge disocijacije, to su HPO42−, vodik-fosfatni anioni. Anioni nakon treće disocijacije su PO43−–fosfatni ili ortofosfatni anioni. U svakoj od gore prikazanih reakcija disocijacije, postoji odvojena disocijacijska konstanta, zvana Ka1, Ka2 i Ka3 data za 25 °C. Vezane sa ove tri disocijacijske konstante su odgovarajuće vrijednosti: pKa1=2,12, pKa2=7,21 i pKa3=12.67 na 25 °C.[5] Iako su sva tri vodikova (H) atoma ekvivalentna u molekuli ortofosforne kiseline, sukcesivne vrijednosti Ka se razlikuju jer je energetski nepovoljnije kada se izgubi drugi H+, ako je jedan (ili više) već izgubiljen, molekula/ion je negativnije naelektrisan(a).[6][7] [8]
Zbog triprotonske disocijacije ortofosforne kiseline, te činjenice da njene konjugirane baze (fosfati gore navedeni) pokrivaju širok pH, općenite netoksičnosti rastvora fosforne kiseline/fosfata, mješavine ove vrste fosfata se često koriste kao buferski agensi ili se od njih prave buferske otopine, gdje željeni pH ovisi o proporciji fosfata u smjesi. Slično tome, netoksične anionske soli triprotonski organski spoj i limunska kiselina se također često koriste kod pravljenja bufera. Fosfati se nalaze ponajviše u biološkim materijalima, posebno u spojevima izvedenim iz fosforiliziranih šećera, kao što su DNK, RNK i adenozin-trifosfat (ATP).
Nakon zagrijavanja ortofosforne kiseline, kondenzacija fosfornih jedinica može biti izazvana kondenzacijom novonastale vode. Kada se ukloni jedna molekula vode za svake dvije molekule fosforne kiseline, rezultat je pirofosforna kiselina (H4P2O7). Kada pređe preko prosjeka jedne molekule vode po fosfornoj jedinici, nastaje staklastokruta tvar, koja ima empirijsku formulu HPO3, a zove se metafosforna kiselina.[9] Metafosforna kiselina je jednostruka bezvodna verzija ortofosforne kiseline, koja se ponekad koristi kao reagens za upijanje vode ili vlage. Dalja dehidracija je vrlo teška, a može se ostvariti samo putem izuzetno jakih isušivača (a ne samo grijanjem). On proizvodi fosforni anhidrid (pentoksid), koji ima empirijsku formulu P2O5, iako stvarna molekula ima hemijsku formulu P4O10. Fosforna kiselina je čvrsta tvar, koja vrlo snažno upija vlagu i koristi se kao isušivač.[6]
U prisustvu superkiselina (jačih od H2SO4), H 3 PO 4, reagira stvaranjem slabo karakteriziranih proizvoda, hipotetski možda korozivnih, kiselih soli[10] tetrahidroksilfosfonijevih iona, koji su izoelektronski sa ortosilicijskom kiselinom. Pretpostavljena reakcija sa HSbF6, naprimjer, predložena je kao:
- H3PO4 + {HSbF6} → [P(OH)4+] [SbF6]−.
Vodena otopina
urediZa datu ukupnu koncentraciju kiseline [A] = [H3PO4] + [H2PO4−] + [HPO42−] + [PO43−] ([A] – je ukupni broj molova čiste H3PO4 koja se uzima za dobijanje 1 L rastvora. Sastav vodene otopine fosforne kiseline može se izrčunati primjenom ravnotežne jednadžbe udružene sa odnosima tri gore opisane reakcije [H+] [OH−] = 10−14 i neutralnosti jednadžbi. Moguća koncentracija polifosfornih molekulskih iona je zanemarena. Sistem se može ograničiti do jednadžbe petog stepena [H+] koja se brojčano rješava na sljedeći način:
| [A] (mol/L) | pH | [H3PO4]/[A] (%) | [H2PO4−]/[A] (%) | [HPO42−]/[A] (%) | [PO43−]/[A] (%) |
| 1 | 1,08 | 91,7 | 8,29 | 6,20×10−6 | 1,60×10−17 |
| 10−1 | 1,62 | 76,1 | 23,9 | 6,20×10−5 | 5,55×10−16 |
| 10−2 | 2,25 | 43,1 | 56,9 | 6.20×10−4 | 2,33×10−14 |
| 10−3 | 3,05 | 10.6 | 89,3 | 6,20×10−3 | 1,48×10−12 |
| 10−4 | 4,01 | 1.30 | 98,6 | 6,19×10−2 | 1,34×10−10 |
| 10−5 | 5,00 | 0.133 | 99,3 | 0,612 | 1,30×10−8 |
| 10−6 | 5,97 | 1,34×10−2 | 94,5 | 5,50 | 1,11×10−6 |
| 10−7 | 6,74 | 1,80×10−3 | 74,5 | 25,5 | 3,02×10−5 |
| 10−10 | 7,00 | 8,24×10−4 | 61,7 | 38,3 | 8,18×10−5 |
Za jake koncentracije kiseline, rastvor se uglavnom pravi od H3PO4. Za [A] = 10−2, pH je blizak pKa1, dajući ekvimolarnu mješavinu H3PO4 i H2PO4−. Za [A] ispod 10−3, rastvor se uglavnom sastavlja od H2PO4− with [HPO42−] kada nastaju razrijeđene rastvorine koje nisu zanemarljive. [PO43−] je uvijek zanemarljiv. Budući da ova analiza ne uzima u obzir koeficijent ionske aktivnosti, pH i molaritet, spravljanje fosforne kiseline može značajno odstupiti od navedenih vrijednosti.
Dobijanje
urediFosforna kiselina se proizvodi industrijski na dva načina: termalno i mokrim procesom, koji uključuje dva pod-metoda. Mokri proces dominira u komercijalnom sektoru. Termalni proces je skuplji i daje čistiji proizvod, koji se koristi za primjenu u prehrambenoj industriji.
Mokri proces
urediMokrim procesom se fosforna kiselina priprema dodavanjem sumporne kiseline u trikalcij-fosfatni kamen, koji se obično nalazi u prirodi kao apatit. Reakcija je:
- Ca5(PO4)3X + 5 H2SO4 + 10 H2O → 3 H3PO4 + 5 CaSO4·2 H2O + HX
- gdje X može uključivati OH, F, Cl i Br.
Početna otopina fosforne kiseline može sadržavati 23–33% P2O5 (32–46% H3PO4), ali se može i koncentrirati isparavanjem vode kod proizvodnje komercijalnih ili merkantilnoh stanja fosforne kiseline, koja sadrži oko 54–62% P2O5 (75–85% H3PO4). Dalje isparavanje vode doprinosi nastanku superfosforne kiseline sa koncentracijom P2O5 preko 70% (što odgovara blizu 100% H3PO4. Međutim, počinju se stvarati pirofosforna i polifosforna kiselina, čineći tečnost visoko viskoznom.[11][12] Razlaganje fosfatne rude pomoću sumporne kiseline daje nerastvorljivi kalcij-sulfat (gips), koji se filtrira i uklanja kao fosfogips. U mokrom procesu, kiselina se može dodatno pročistiti uklanjanjem fluora za proizvodnju životinjskog stanja fosforne kiseline ili ekstrakcijom otapala i uklanjanjem arsena prilikom proizvodnje za hranu pogodne fosforne kiseline.
Proces nitrofosfata je sličan mokrom procesu, osim što koristi dušičnu kiselinu umjesto sumporne. Prednost ovog hemijskog procesa je da je sporedni, kalcij-nitrat također biljno gnjojivo. Ovaj metod se rijetko primjenjuje.
Toplinski proces
urediVrlo čista fosforna kiselina se dobija sagorijevanjem elementarnog fosfora za proizvodnju fosfor-pentoksida, koji se naknadno rastvara u razblaženoj fosfornoj kiselini. Na ovaj način se proizvodi veoma čista fosforna kiselina, jer se većina prisutnih nečistoća u stijeni uklanja kada se fosfor izdvaja iz stijene u peći. Krajnji rezultat je termo fosforna kiselina koja je pogodna za hranu. Međutim, za kritične primjene može biti potrebna dodatna obrada za uklanjanje spojeva arsena. Elementarni fosfor nastaje u električnoj peći. Na visokoj temperaturi, mješavina fosfatne rude, silicija i ugljikovih materijala (koks, ugalj itd.) proizvodi kalcij-silikat, fosforni plin i ugljen-monoksid. Otpušteni P i CO plinovi iz ove reakcije se hlade pod vodom i izoliraju čvrsti fosfor. Otpušteni P i CO gasovi mogu biti spaljeni sa zrakom prilikom proizvodnje fosfor pentoksida i ugljen-dioksida.
Laboratorijski način
urediProces laboratorijskog demonstriranja uključuje oksidaciju crvenog fosfora pomoću dušične kiseline.[13]:
- 1/n Pn + 5 HNO3 → H2O + H3PO4 + 5 NO2
Upotreba
urediGlavna upotreba fosforne kiseline je kod proizvodnje vještački đubriva, gdje se troši oko 90% od cjelokupne proizvodnje.[14]
| Primjena | Potražnja (2006.) u hiljadama tona | Glavni fosfatni derivat |
| Sapuni i deterdženti | 1836 | STPP |
| Industrija hrane | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP (NaA, MCP, DSP (Na2HPO4), H3PO4 |
| Vodeni tretman | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Pasta za zube | 68 | DCP (CaHPO4), IMP, SMFP |
| Ostale primjene | 287 | STPP (Na3P3O9), TCP, APP, DAP, Cink-fosfat (Zn3(PO4)2), aluminij-fosfat (AlPO4, H3PO4) |
Prehrambeni aditivi
urediFosforna kiselina za prehrambene potrebe (aditive E338[15] se koristi za zakiseljavanje hrane i pića, kao što su raznorazne Cole i džemovi. Oni daju pikantan ili kiselkast okus. Razne soli fosforne kiseline, kao što je monokalcij-fosfat, koriste se kao agensi za previranje.[14]
Također pogledajte
urediReference
uredi- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Pristupljeno 6. 2. 2014.
- ^ Atkins P., de Paula J. (2006). Physical chemistry, 8th Ed. San Francisco: W. H. Freeman. ISBN 0-7167-8759-8.
- ^ Whitten K.W., Gailey K. D. and Davis R. E. (1992). General chemistry, 4th Ed. Philadelphia: Saunders College Publishing. ISBN 0-03-072373-6.
- ^ Klement, R. (1963) "Orthophosphoric Acid" in Handbook of Preparative Inorganic Chemistry, 2nd ed., G. Brauer (ed.), Academic Press, NY. Vol. 1. p. 543.
- ^ Weast, Robert C., ured. (1983). CRC Handbook of Chemistry and Physics (64th izd.). Boca Raton, Florida: CRC Press. str. D-169. ISBN 0-8493-0464-4.
- ^ a b Petrucci R. H., Harwood W. S., Herring F. G. (2002). General Chemistry, 8th Ed. New York: Prentice-Hall. ISBN 0-13-014329-4.CS1 održavanje: više imena: authors list (link)
- ^ Laidler K. J. (1978). Physical chemistry with biological applications. Benjamin/Cummings. Menlo Park. ISBN 0-8053-5680-0.
- ^ Weast R. C., Ed. (1990). CRC Handbook of chemistry and physics. Boca Raton: Chemical Rubber Publishing Company. ISBN 0-8493-0470-9.
- ^ phosphoric acid. The Columbia Encyclopedia, Sixth Edition.
- ^ Gevrey, S.; Luna, A.; Haldys, V.; Tortajada, J.; Morizur, J. P. (1998). "Experimental and theoretical studies of the gas-phase protonation of orthophosphoric acid". The Journal of Chemical Physics. 108 (6): 2458. Bibcode:1998JChPh.108.2458G. doi:10.1063/1.475628.
- ^ Thomas, W P and Lawton, W S "Stable ammonium polyphosphate liquid fertilizer from merchant grade phosphoric acid" Šablon:US Patent, Issue date: January 26, 1988
- ^ "Super Phosphoric Acid 0-68-0 Material Safety Data Sheet" (PDF). J.R. Simplot Company. maj 2009. Arhivirano s originala (PDF), 16. 7. 2011. Pristupljeno 4. 5. 2010.
- ^ Arthur Sutcliffe (1930) Practical Chemistry for Advanced Students (1949 Ed.), John Murray – London.
- ^ a b Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" in Ullmann's Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim. doi:10.1002/14356007.a19_465.pub3
- ^ "Current EU approved additives and their E Numbers". Foods Standards Agency. 14. 3. 2012. Pristupljeno 22. 7. 2012.
Vanjski linkovi
uredi- http://www.food-info.net/uk/e/e-alphabet.htm Veoma dugačak spisak na engleskom jeziku
- *http://www.halal.ba, podaci o E-brojevima (bos.)
