Kalij-cijanid
Kalij-cijanid je spoj hemijske formule KCN, odnosno kalijeva so cijanovodične kiseline. To je bezbojna kristalna so, izgleda sličnog šećeru, relativno dobro rastvorljiva u vodi. KCN se najvećim dijelom koristi za preradu rude zlata, u organskim sintezama i za elektroplatiranje (galvanizaciju).[1] Osim toga, u nešto manjem obimu koristi se u izradi nakita za hemijsko pozlaćivanje i poliranje.[2]
| Kalij-cijanid | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Kalij-cijanid |
| Druga imena | Cijankalij |
| Molekularna formula | KCN |
| CAS registarski broj | 151-50-8 |
| SMILES | [K+].[C-]#N |
| InChI | 1/CN.K/c1-2;/q-1;+1 |
| Kratki opis | Bezbojni kristali |
| Osobine1 | |
| Molarna masa | 65,12 g/mol |
| Agregatno stanje | Čvrsto |
| Gustoća | 1,52 g/cm3 |
| Tačka topljenja | 634 °C |
| Tačka ključanja | 1625 °C |
| Rastvorljivost | 71,6 g/100 ml (25 °C) 100 g/100 ml (100 °C) |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
KCN je izuzetno otrovan. Vlažna supstanca KCN otpušta male količine cijanovodika (HCN) zbog hidrolize, a koji miriše poput gorkih badema.[3] Međutim, svaki čovjek ne može osjetiti taj miris, a mogućnost osjetila povezana je s genetičkim predispozicijama čovjeka.[4] Okus kalij-cijanida je opisan kao oštar, kiseo uz osjećaj peckanja i gorenja.[5]
Dobijanje uredi
KCN se dobija tretiranjem cijanovodika vodenim rastvorom kalij-hidroksida, nakon čega slijedi isparavanje rastvora u vakuumu:[6]
U prošlosti se dobijao reakcijom ugljik-monoksida i amonijaka s kalij-karbonatom pri visokim temperaturama. U ovoj reakciji, pri kojoj je željezo bilo katalizator, osim kalij-cijanida nastaju voda, plinoviti vodik i ugljik-dioksid:
U laboratoriji je moguće pripremanje kalij-cijanida od kalij-heksacijanidoferata(III) i sumporne kiseline. Nastala cijanovodična kiselina neutralizira se rastvorom kalij-hidroksida, nakon čega se KCN može istaložiti pomoću etanola. Moguće je i dobijanje putem redukcije kalij-cijanata pri visokim temperaturama:
Godišnje se u svijetu proizvede približno 50.000 tona kalij-cijanida.[2]
U 19. vijeku, prije otkrića Castnerovog procesa, kalij-cijanid bio je jedan od najvažnijih izvora cijanida alkalnih metala.[2] U tom zastarjelom procesu kalij-cijanid dobijao se razlaganjem kalij-ferocijanida:[7]
Struktura uredi
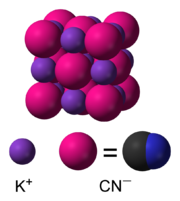
U vodenom rastvoru KCN disocira na hidrirane ione kalija (K+) i cijanidne ione (CN−). Uobičajeni oblik kalij-cijanida u čvrstom stanju, koji je stabilan u uslovima sobne temperature i normalnog pritiska, ima istu kubičnu kristalnu strukturu kao i natrij-hlorid, gdje je svaki ion kalija okružen sa po šest iona cijanida i obrnuto. Iako su cijanidni ioni dvoatomski, te zbog toga manje simetrični od iona hlorida, oni se vrlo brzo rotiraju, pa je njihov "prosječan" oblik sferičan. Pri niskim temperaturama i visokom pritisku ova slobodna rotacija unutar iona je onemogućena, čime je kristalna struktura mnogo manje simetrična, a ioni cijanida su postavljeni slojevito.[8][9]
Upotreba uredi
Cijanidi KCN i NaCN (natrij-cijanid) široko su korištene soli u organskim sintezama, najčešće za pripremanje nitrila i karboksilnih kiselina, posebno Von Richterovom reakcijom. Također se koristi i za sintezu hidantiona (glikoliluree), izrazito korisnog sintetičkog međuproizvoda, koji reagira s nekim karbonilnim spojem, poput aldehida ili ketona u prisustvu amonij-karbonata.
KCN se koristi kao sredstvo za fiksiranje fotografija na vlažnu ploču pomoću koloidnog procesa.[10] Ovaj spoj rastvara srebro tamo gdje je zbog razvijača postalo nerastvorljivo. Time nastaje fotografija i stabilizira se, te prestaje biti osjetljiva na svjetlost. Moderni fotografi koji koriste vlažnu ploču danas upotrebljavaju manje otrovne fiksatore, najčešće mnogo manje otrovni natrij-tiosulfat, mada ni upotreba kalij-cijanida nije u potpunosti prestala.
U industriji zlata, KCN u prisustvu metalnog zlata iz rude te kisika i vode iz zraka s njima gradi so kalij-zlato cijanid (ili zlato-kalij cijanid), rastvorljivu u vodi, i kalij-hidroksid:
- 4 Au + 8 KCN + O2 + 2 H2O → 4 K[Au(CN)2] + 4 KOH
Sličan proces odvija se i upotrebom NaCN, čime se dobija natrij-zlato cijanid (NaAu(CN2)).
Otrovnost uredi
Kalij-cijanid je vrlo snažan inhibitor ćelijskog disanja, djelujući na mitohondrijsku citohrom c oksidazu, čime blokira oksidativnu fosforilaciju. Time se organizam onemogućuje da oksidira hranu i iz nje dobija energiju. Zatim se javlja laktatna acidoza kao posljedica anaerobnog metabolizma. Akutno trovanje cijanidom najprije uzrokuje crvenilo ili rumenilo na licu i koži žrtve jer njeno tijelo nije u mogućnosti koristiti kisik iz krvi. Efekti trovanja kalij-cijanidom isti su kao i kod trovanja natrij-cijanidom, a simptomi se obično javljaju u roku nekoliko minuta nakon gutanja supstance. Žrtva gubi svijest, nakon čega slijedi moždana smrt. Tokom ovog perioda žrtva može doživjeti i snažne grčeve. Uzrok smrti je cerebralna hipoksija.
Približna smrtonosna doza kalij-cijanida za čovjeka (80 kg mase) iznosi 200 do 300 mg.[11] Njegova otrovnost pri oralnom unosu zavisi od kiselosti u želucu, jer KCN mora reagirati s kiselinom kako bi se oslobodio cijanovodik (HCN), koji je smrtonosni oblik cijanida. Ruski sveštenik Grigorij Rasputin preživio je trovanje kalij-cijanidom jer je kiselost u njegovom želucu bila neuobičajeno niska.[12]
Brojne poznate osobe su ubijene ili počinile samoubistvo pomoću kalij-cijanida, kao što su članovi organizacije Mlada Bosna i brojni čuveni nacisti u Trećem rajhu poput Rommela, Hitlerove dugogodišnje parterice Eve Braun, Josepha Goebbelsa, Heinricha Himmlera i Hermanna Göringa, kao i britanski agenti iz doba Drugog svjetskog rata, zatim računarski naučnik Alan Turing, hemičari Wallace Carothers i Viktor Meyer,[13] te brojne samoubice pripadnici raznih vjerskih sekti kao što je Hram naroda. Danski pisac Gustav Wied također je počinio samoubistvo uzimajući ovaj spoj. Osuđeni ratni zločinac Slobodan Praljak počinio je samoubistvo ispijajući sadržaj iz bočice za koju se sumnja da je sadržavala kalij-cijanid, neposredno nakon što mu je potvrđena kazna pred Međunarodnim krivičnim sudom u Haagu 29. novembra 2017. godine.[14]
Za dekontaminaciju kalij-cijanida najefikasniji je vodik-peroksid ili rastvor natrij-hipohlorita. Takvi rastvori bi se trebali aplicirati u što kraćem roku kako bi se onemogućilo nastajanje cijanovodika:[2]
Kao protivotrov pri trovanju kalcij-cijanidom, američka vojska standardno primjenjuje inhalaciju male doze amil nitrita, nakon čega slijedi intravenozna injekcija natrij-nitrita, poslije čega je također intravenozno potrebno unijeti natrij-tiosulfat.[15] Osim toga, jedan od efikasnijih protivotrova je i provitamin B12 (hidroksokobalamin).
Reference uredi
- ^ Duward Shriver, Mark Weller, Tina Overton, Jonathan Rourke, Fraser Armstrong (2014). Inorganic Chemistry (6. izd.). New York: W. H. Freeman & Co. str. 324. ISBN 9781429299060. LCCN 2013950573.CS1 održavanje: više imena: authors list (link)
- ^ a b c d Andreas Rubo, Raf Kellens, Jay Reddy, Joshua Wooten, Wolfgang Hasenpusch (2006). "Alkali Metal Cyanides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.i01_i01.CS1 održavanje: više imena: authors list (link)
- ^ "Suicide note reveals taste of cyanide" (jezik: engleski). Pristupljeno 2. 12. 2017.
- ^ "Cyanide, inability to smell". omim.org (jezik: engleski). Pristupljeno 2. 12. 2017.
- ^ "The only taste: Cyanide is acrid". hindustantimes.com. Hindustan Times.
- ^ Pradyot Patnaik (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ^ Von Wagner, Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co. str. 474 & 477.
- ^ "Crystallography Open Database, Structure of KCN". Pristupljeno 2. 12. 2017.
- ^ H. T. Stokes; D. L. Decker; H. M. Nelson; J. D. Jorgensen (1993). "Structure of potassium cyanide at low temperature and high pressure determined by neutron diffraction". Physical Review B. 47 (17): 11082–11092. doi:10.1103/PhysRevB.47.11082.CS1 održavanje: više imena: authors list (link)
- ^ J. Towler, MD. (1864). The Silver Sunbeam. str. 119. ISBN 9781160028028., reizdanje 1974.
- ^ John Harris Trestrail III (2007). Criminal Poisoning - Investigational Guide for Law Enforcement, Toxicologists, Forensic Scientists, and Attorneys (2 izd.). Springer Science & Business Media. str. 119. ISBN 9781588299215.
- ^ John Emsley (2006). The Elements of Murder: A History of Poison. OUP Oxford. str. 73. ISBN 9780192806000.
- ^ "Top 10 Scientists who Committed Suicide". 7. 10. 2007. Pristupljeno 3. 12. 2017.
- ^ "War criminal 'took cyanide' in Hague court". BBC News (jezik: engleski). 1. 12. 2017. Pristupljeno 1. 12. 2017.
- ^ "Cyanide Toxicity". Pristupljeno 3. 12. 2017.
Vanjski linkovi uredi
| Commons ima datoteke na temu: Kalij-cijanid |
- Anand Kumar Pandey; Ranjana Patnaik; Dafin F. Muresanu; Aruna Sharma; Hari Shanker Sharma (2012). "Quercetin in Hypoxia-Induced Oxidative Stress: Novel Target for Neuroprotection". International Review of Neurobiology. 102: 107–146. doi:10.1016/B978-0-12-386986-9.00005-3.CS1 održavanje: više imena: authors list (link)
